标准溶液制备方法
1.适用范围
用于制备准确浓度的溶液,应用于容量法测定物质的含量。
2.一般规定
2.1 配制标准溶液的试剂至少为分析纯试剂,水为蒸馏水或相当纯度的水;标定用的试剂应为基准试剂。
2.2 分析天平的砝码、滴定管、容量瓶和移液管等均需定期校正。
2.3 标定标准溶液浓度时,平行试验不得少于8次,2人各作四平行。每人四平行测定结果的极差以及2人测定结果平均值之差与平均值之比对于0.5mol/L浓度的标准溶液均不得大于0.1%,对于0.1mol/L浓度的标准溶液均不得大于0.5%(即第4位有效数字之差值不得大于5)。
2.4 制备的标准溶液浓度与规定浓度相对误差不得大于5%。
2.5 滴定分析用标准溶液应在常温(15~25℃)下标定和使用,保存时间一般不得超过3个月。
3.定量分析的误差
绝对误差:实验测得数值与真实数值的差。
相对误差:误差在测量数值中所占的百分率。
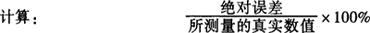
准确:测定结果与真实数值间的差别程度。
精密:指在相同条件下进行多次测定后所得数据的符合程度。
4.有效数字
它的确定是根据测量方法和测量仪器的准确程度来决定的,一般应使测量的数目中只有最后1位数字是可疑的。几个数相加(或相减)时,它们的和(或差)的有效数字的保留,应以小数点后位数最少的数字为准;乘除时,所得的积或商的百分准确度,不能高于所有数目中准确程度最低者。
5.标准溶液的配制与标定
5.1 氢氧化钠标准溶液 c(NaOH)=0.5mol/L及c(NaOH)=0.1mol/L。
5.1.1 配制:将氢氧化钠配成饱和溶液(NaOH约120g加水100mL),注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液,注入1000mL不含二氧化碳的水中,摇匀。
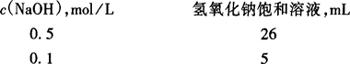
5.1.2 标定:
5.1.2.1 测定方法:称取下述规定量的于105~110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0002g,溶于下述规定的体积的不含二氧化碳的水中,加2滴酚酞指示液,用配制好的氢氧化钠溶液滴定至溶液呈粉红色,同时作空白试验。

5.1.2.2 计算:氢氧化钠标准溶液浓度按式(14-28)计算。
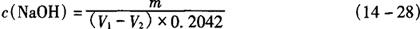
式中 c(NaOH)——氢氧化钠标准溶液的浓度,mol/L
m——邻苯二甲酸氢钾的质量,g
V1——滴定所用氢氧化钠标准溶液的体积,mL
V2——空白试验所用氢氧化钠标准溶液的体积,mL
0.2042——与1.00mL氢氧化钠标准溶液相当的以克表示的邻苯二甲酸氢钾的质量
5.2 盐酸标准溶液 c(HCl)=0.5mol/L及c(HCl)=0.1mol/L。
5.2.1 配制:量取下述规定体积的盐酸(相对密度为1.19,)注入1000mL水中,摇匀。
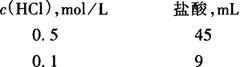
5.2.2 标定:
5.2.2.1 测定方法:称取下述规定量的于270~300℃灼烧至恒重的基准无水碳酸钠,称准至0.0002g,置于250mL锥形瓶中,用50mL蒸馏水溶解,加10滴溴甲酚绿——甲基红混合指示液,用配制好的盐酸标准溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同时作空白试验。

5.2.2.2 计算:盐酸标准溶液浓度按式(14-29)计算。
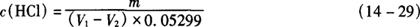
式中 c(HCL)——盐酸标准溶液的浓度,mol/L
m——无水碳酸钠的质量,g
V1——滴定所用盐酸标准溶液的体积,mL
V2——空白试验所用盐酸标准溶液的体积,mL
0.05299——与1.00mL盐酸标准溶液相当的以克表示的无水碳酸钠的质量
5.3 硫酸标准溶液 c(1/2H2SO4)=0.5mol/L及c(1/2H2SO4)=0.1mol/L。
5.3.1 配制:量取下述规定体积的硫酸(相对密度为1.84),缓缓注入1000mL水中,冷却后摇匀。

5.3.2 标定:
5.3.2.1 测定方法:称取下述规定量的于270~300℃灼烧至恒重的基准无水碳酸钠,称准至0.0002g,置于250mL锥形瓶中,用50mL蒸馏水溶解,加10滴溴甲酚绿-甲基红混合指示液,用配制好的硫酸标准溶液滴定至溶液由绿色转变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同时作空白试验。
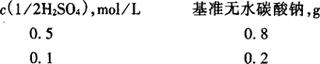
5.3.2.2 计算:硫酸标准溶液浓度按式(14-30)计算。
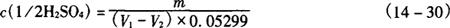
式中 c(1/2H2SO4)——硫酸标准溶液的浓度,mol/L
m——无水碳酸钠的质量,g
V1——滴定所用硫酸标准溶液的体积,mL
V2——空白试验所用硫酸标准溶液的体积,mL
0.05299——与1.00mL硫酸标准溶液相当的以克表示的无水碳酸钠的质量
5.4 氢氧化钾乙醇标准溶液 [c(KOH·C2H5OH)=0.1mol/L]。
5.4.1 配制:称取6g氢氧化钾,溶于1000mL95%乙醇中,静置使澄清,小心倾取上层透明溶液,或过滤贮存于玻璃瓶中。
5.4.2 标定:
5.4.2.1 测定方法:准确量取25mL盐酸[c(HCl)=0.1mol/L]标准溶液,加50mL不含二氧化碳的水及2滴酚酞指示液,用配制好的氢氧化钾乙醇溶液滴定至溶液呈粉红色。
5.4.2.2 计算:氢氧化钾乙醇标准溶液浓度按式(14-31)计算。
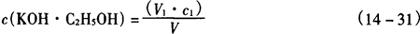
式中 c(KOH·C2H5OH)——氢氧化钾乙醇标准溶液的浓度,mol/L
V1——盐酸标准溶液的体积,mL
c1——盐酸标准溶液的浓度,mol/L
V——滴定所用氢氧化钾乙醇标准溶液的体积,mL
6.注意事项
6.1 配制NaOH标准溶液时,应先将固体的NaOH配成饱和溶液,注入塑料桶中密闭放置至溶液清亮备用,因NaOH固体极易吸收空气中的CO2和H2O,使变成Na2CO3。
6.2 装NaOH标准溶液的玻璃瓶不能用玻璃塞盖,易被腐蚀。
6.3 标定酸标准溶液用的基准Na2CO3应在270~300℃马弗炉中干燥,但烘时温度不能过高,因Na2CO3在300℃以上高温时易部分分解成氧化物。
7.其他溶液的配制
7.1 精制乙醇(95%) 于每1000mL乙醇中加入1gAgNO3溶于5mL水的溶液,充分混合。另溶解5g氢氧化钾于25mL温热乙醇中,冷却后,缓缓加于上述溶液中,回流4h,蒸馏。
7.2 中性精制乙醇或分析纯乙醇(95%) 取适量精制乙醇或分析纯乙醇,加热,加数滴酚酞指示液,趁热用0.1mol/L氢氧化钠或氢氧化钾溶液中和。
7.3 0.5mol/L氢氧化钾-乙醇溶液 溶解30g氢氧化钾于1000mL精制乙醇中(95%),静置使澄清,小心倾取上层透明溶液,或过滤贮存于玻璃瓶中。溶液如呈现微黄色时则不得应用。
7.4 羟胺溶液 溶解20g盐酸羟胺(分析纯)于40mL蒸馏水中,用95%乙醇稀释至400mL,继加300mL氢氧化钾乙醇溶液(0.5mol/L)。将溶液搅匀后加入5.0mL溴酚蓝指示液,静置0.5h后过滤备用。该试剂在应用时须新鲜配制。或可将盐酸羟胺溶液与氢氧化钾乙醇溶液各置一瓶,应用时再混合。
7.5 0.5mol/L盐酸羟胺溶液 溶解40g盐酸羟胺(分析纯)于50mL蒸馏水中,加入900mL的95%乙醇,再加10mL0.1%溴酚蓝指示液(用50%乙醇配制),加入足够量的0.5mol/L氢氧化钠溶液,使溶液由黄色转呈黄绿色,或用pH计调节酸度至pH3~4之间的一点。
8.指示剂溶液制备
8.1 酚酞 1.0g溶于60mL95%乙醇中,加水稀释至100mL。
8.2 溴酚蓝 取溴酚蓝0.10g加50%的乙醇100mL溶解后,过滤,即得。
8.3 甲基红指示液 称取0.20g甲基红,溶于100mL95%乙醇中。
8.4 溴甲酚绿指示液 称取0.10g溴甲酚绿,溶于100mL95%乙醇中。
8.5 溴甲酚绿-甲基红指示液 将溴甲酚绿指示液与甲基红指示液按3+1体积比混合,摇匀。
8.6 酚红指示液 称取0.1g酚红,溶于100mL95%乙醇中。
- 关系判断是什么意思
- 关系团体论是什么意思
- 关系国计民生的主要产品是什么意思
- 关系图是什么意思
- 关系型数据库应用是什么意思
- 关系学是什么意思
- 关系学是什么意思
- 关系学是什么意思
- 关系家庭疗法是什么意思
- 关系户是什么意思
- 关系推理是什么意思
- 关系推理是什么意思
- 关系数据库的理论及应用是什么意思
- 关系数据库管理系统是什么意思
- 关系映射反演方法是什么意思
- 关系特征是什么意思
- 关系理论是什么意思
- 关系疗法是什么意思
- 关系的传递性是什么意思
- 关系的否定是什么意思
- 关系的对称性是什么意思
- 关系的活动不断增加,通过制定信托法,有利于调整信托关系和规范信托活动,因此,法律委员会建议经本次常委会会议审议通过。是什么意思
- 关系的自返性是什么意思
- 关系网是什么意思
- 关系网是什么意思
- 关系联想是什么意思
- 关系营销是什么意思
- 关系营销是什么意思
- 关索征南是什么意思
- 关纯是什么意思
- 关绍宁是什么意思
- 关绍宗是什么意思
- 关绍宗是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽是什么意思
- 关羽(1)是什么意思
- 关羽(2)是什么意思
- 关羽不访蒋干是什么意思
- 关羽为何是眯缝眼是什么意思
- 关羽义斩貂蝉是什么意思
- 关羽之死是什么意思
- 关羽出世是什么意思
- 关羽刮骨是什么意思
- 关羽卖豆腐红脸是什么意思
- 关羽形象悲剧美初探是什么意思
- 关羽打鱼是什么意思
- 关羽擒将图是什么意思
- 关羽春秋楼是什么意思
- 关羽横挑担是什么意思
- 关羽画竹明志是什么意思
- 关羽的姓和名字是什么意思
- 关羽的脚印是什么意思