一氧化氮
一氧化氮yiyanghuadan
化学式NO,无色气体,沸点很低 (-152℃),在水中溶解度小,不与水反应,较易溶于乙醇。一氧化氮比一氧化碳或氮分子多一个电子,故有顺磁性。按分子轨道法在反键轨道π*p上有一个电子,分子结构式为 ,有一个σ键,一个π键和一个三电子π键,键级为2.5。一氧化氮的分子结构与其偶极矩一致。在低温时,可双聚成不稳定的逆磁性的二聚体 (NO)2蓝色固体。虽然一氧化氮为吸热化合物 (标准生成焓△Hf为90.4kJ·mol-1),由于分子内以三键结合故分子热稳定性高,高于1 000℃时才开始分解。一氧化氮具有还原性,易被空气中的氧所氧化,接触空气立即可化合成红棕色的二氧化氮。一氧化氮结构上不饱和,故可发生加合反应:
2NO+Cl2=2NOCl
产物氯化亚硝酰NOCl为共价分子,分子式应写成ClNO,结构式为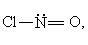 其中氮原子采取不等性SP2杂化。一氧化氮既有未成对的电子,也有孤电子对,可以作为配位体,与某些金属盐结合成配合物,例如,与硫酸亚铁溶液作用生成深棕色的硫酸亚硝基铁[Fe(NO)SO4]。此配合物不稳定,加热又可放出一氧化氮,可利用此反应提纯一氧化氮。分析化学中也常用此棕色配合物的生成来检定NO-3,其方法是将欲检定的含NO-3物质在酸性条件下与硫酸亚铁作用,生成的一氧化氮与未反应的过量硫酸亚铁形成棕色的[Fe(NO)]SO4:
其中氮原子采取不等性SP2杂化。一氧化氮既有未成对的电子,也有孤电子对,可以作为配位体,与某些金属盐结合成配合物,例如,与硫酸亚铁溶液作用生成深棕色的硫酸亚硝基铁[Fe(NO)SO4]。此配合物不稳定,加热又可放出一氧化氮,可利用此反应提纯一氧化氮。分析化学中也常用此棕色配合物的生成来检定NO-3,其方法是将欲检定的含NO-3物质在酸性条件下与硫酸亚铁作用,生成的一氧化氮与未反应的过量硫酸亚铁形成棕色的[Fe(NO)]SO4:
6FeSO4+3H2SO4+2HNO3
=3Fe2(SO4)3+2NO↑+4H2O
NO+FeSO4=[Fe(NO)]SO4
NO+NO2+3H2SO4=2NO++3HSO-4+H3O+
一氧化氮可由稀硝酸作用于铜屑或由氨催化氧化来制得。
☚ 氨合物 二氧化氮 ☛
- 个白子是什么意思
- 个百是什么意思
- 个百多只是什么意思
- 个百宽只是什么意思
- 个百零一是什么意思
- 个百零八条槃是什么意思
- 个百零首歌是什么意思
- 个的是什么意思
- 个的个儿是什么意思
- 个的野是什么意思
- 个盏是什么意思
- 个盹呃是什么意思
- 个碗双箸是什么意思
- 个票是什么意思
- 个私经济是什么意思
- 个税起征点是什么意思
- 个空个窟是什么意思
- 个空个隙是什么意思
- 个管是什么意思
- 个篇是什么意思
- 个篷是什么意思
- 个紧子是什么意思
- 个统是什么意思
- 个罗国是什么意思
- 个老子是什么意思
- 个肚是什么意思
- 个股是什么意思
- 个股花是什么意思
- 个能是什么意思
- 个脉是什么意思
- 个腹是什么意思
- 个臣是什么意思
- 个自是什么意思
- 个般是什么意思
- 个般母是什么意思
- 个色是什么意思
- 个苦子是什么意思
- 个茅子是什么意思
- 个落是什么意思
- 个葛辰光是什么意思
- 个蒲是什么意思
- 个薄子是什么意思
- 个行是什么意思
- 个衍是什么意思
- 个装、内装、外装是什么意思
- 个西是什么意思
- 个调是什么意思
- 个调成是什么意思
- 个调税是什么意思
- 个豆是什么意思
- 个贴是什么意思
- 个趟是什么意思
- 个跤是什么意思
- 个身是什么意思
- 个转摞是什么意思
- 个软子是什么意思
- 个辰光是什么意思
- 个边是什么意思
- 个这是什么意思
- 个通是什么意思