同离子效应
同离子效应tonglizi xiaoying
由于加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应。分别说明如下:
❶使弱电解质电离度减小 例如,在醋酸溶液中加入醋酸钠,由于醋酸钠是强电解质,在水中全部电离成Na+和Ac-,溶液中Ac-浓度增大,大量的Ac-同
H+结合成醋酸分子,使醋酸的电离平衡向左移动:
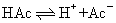
因此,醋酸的电离度减小,溶液中H+浓度降低。在弱碱溶液中加入弱碱盐,例如,在氨水中加入氯化铵,也存在同离子效应。有同离子效应时计算氢离子浓度的一般公式为:
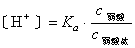
式中Ka为弱酸的电离常数,c为浓度。同理可得
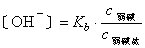
式中 Kb为弱碱的电离常数。
❷使难溶盐溶解度降低 例如,硫酸钡饱和溶液中,存在如下平衡:
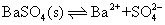
在上述饱和溶液中加入氯化钡,由于氯化钡完全电离,溶液中〔Ba2+〕 突然增大,〔Ba2+〕 〔SO2-4〕>Ksp,原来的平衡遭到破坏,平衡向左移动,析出BaSO4沉淀。当溶液中再次建立新的平衡,即〔Ba2+〕 〔SO2-4〕 =Ksp时,〔Ba2+〕 大于BaSO4溶解在纯水中的钡离子浓度,而 〔SO2-4〕则小于BaSO4溶解在纯水中的硫酸根浓度,硫酸钡的溶解度可用新的平衡状态下的 〔SO2-4〕 来量度。因此,BaSO4在BaCl2溶液中的溶解度比在纯水中要小。即加入含相同离子的强电解质BaCl2使难溶盐BaSO4的溶解度降低。同离子效应也可以降低易溶电解质的溶解度。例如,在饱和的NaCl溶液中加入浓盐酸或通入氯化氢气体,也可以使NaCl晶体析出。
☚ 离子迁移数 缓冲溶液 ☛
同离子效应
在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,而使弱电解质电离度减小的现象;在难溶电解质溶液中加入与难溶电解质具有相同离子的强电解质,而使难溶电解质溶解度降低的现象。
- 煎春笋块是什么意思
- 煎死是什么意思
- 煎水是什么意思
- 煎水作冰是什么意思
- 煎水外洗是什么意思
- 煎氽大虾是什么意思
- 煎氽蛤仁是什么意思
- 煎汤是什么意思
- 煎汤洗臀是什么意思
- 煎沙烂石是什么意思
- 煎没六鱼是什么意思
- 煎法是什么意思
- 煎泪是什么意思
- 煎泽草是什么意思
- 煎渴是什么意思
- 煎澤草是什么意思
- 煎灯是什么意思
- 煎灼是什么意思
- 煎炒是什么意思
- 煎炒馆是什么意思
- 煎烦是什么意思
- 煎烹是什么意思
- 煎烹猪肝是什么意思
- 煎焖子是什么意思
- 煎焖羊肉是什么意思
- 煎煎是什么意思
- 煎煎饼赛跑是什么意思
- 煎煠是什么意思
- 煎煮是什么意思
- 煎熬是什么意思
- 煎熬逼迫是什么意思
- 煎熯是什么意思
- 煎牛肉饼(汉堡牛排)是什么意思
- 煎牛肝串是什么意思
- 煎牛里脊片是什么意思
- 煎猪排橘汁是什么意思
- 煎猪油是什么意思
- 煎猪肉串是什么意思
- 煎猪肝是什么意思
- 煎盐叠雪是什么意思
- 煎盐堆雪是什么意思
- 煎盐草地纵野火延烧是什么意思
- 煎盘上的蚂蚁,没奔一头处是什么意思
- 煎督是什么意思
- 煎米是什么意思
- 煎糍是什么意思
- 煎糜是什么意思
- 煎糟是什么意思
- 煎红是什么意思
- 煎肉饼是什么意思
- 煎肠伐胃是什么意思
- 煎胶续弦是什么意思
- 煎能是什么意思
- 煎膏剂是什么意思
- 煎膏炊骨是什么意思
- 煎茱萸是什么意思
- 煎茶是什么意思
- 煎茶初精制连续化设备是什么意思
- 煎茶坪题壁(其一) - 清·张问陶是什么意思
- 煎茶岭超基性岩是什么意思