含铝化合物的相互转化
含铝化合物的相互转化han lu huahewu de xianghuzhuanhua
铝的化合物主要包括氧化铝、氢氧化铝、铝盐和偏铝酸盐。在它们相互转化的过程中,氢氧化铝的两性起重要作用,它的电离方程式如下:
H++AlO-2+H2O![]() Al(OH)3
Al(OH)3![]() 3OH-+Al3+
3OH-+Al3+
酸式电离 碱式电离
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
可溶性铝盐、氢氧化铝、可溶性偏铝酸盐相互转化的关系如下:
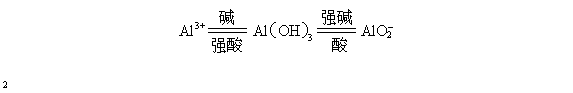
Al3++3OH-=Al(OH)3↓
Al3++3NH3·H2O=Al(OH)3↓+3NH+4
Al(OH)3+OH-=AlO-2+2H2O
可溶性偏铝酸盐与强酸或弱酸均可反应,生成氢氧化铝:
AlO-2+H++H2O=Al(OH)3↓
2AlO-2+CO2(不足)+3H2O=2Al(OH)3↓+CO2-3
AlO-2+CO2(过量)+2H2O=Al(OH)3↓+HCO-3
Al(OH)3+3H+=Al3++3H2O
此外,铝离子和偏铝酸根离子在水中水解较强烈,两种离子在水中相遇,可发生双水解反应,转化为氢氧化铝沉淀:
Al3++3AlO-2+6H2O=4Al(OH)3↓
☚ 铝与强碱溶液的反应 盐类的水解反应 ☛
- 打蹭儿是什么意思
- 打蹲是什么意思
- 打蹲儿是什么意思
- 打蹶子是什么意思
- 打躬是什么意思
- 打躬作揖是什么意思
- 打躬势是什么意思
- 打軱踝儿是什么意思
- 打车是什么意思
- 打车子是什么意思
- 打车毂辘把式是什么意思
- 打车轮子是什么意思
- 打车轱轮儿是什么意思
- 打车轱辘是什么意思
- 打车轱辘把式是什么意思
- 打转是什么意思
- 打转圜是什么意思
- 打转崽是什么意思
- 打转悠是什么意思
- 打转斗是什么意思
- 打转身是什么意思
- 打转转是什么意思
- 打转颠倒是什么意思
- 打转风是什么意思
- 打轮是什么意思
- 打轮廓阶段是什么意思
- 打轮秋是什么意思
- 打软儿是什么意思
- 打软包儿是什么意思
- 打软腿儿是什么意思
- 打软腿子是什么意思
- 打轱辘是什么意思
- 打较是什么意思
- 打辄是什么意思
- 打输呃是什么意思
- 打输赢是什么意思
- 打辖去是什么意思
- 打辣子是什么意思
- 打辣雷是什么意思
- 打辣露霜是什么意思
- 打辩儿是什么意思
- 打辫子是什么意思
- 打边帮鼓是什么意思
- 打边心是什么意思
- 打边炉是什么意思
- 打边鼓是什么意思
- 打迁是什么意思
- 打过偏手是什么意思
- 打过堂儿是什么意思
- 打过手是什么意思
- 打过河是什么意思
- 打过膛儿是什么意思
- 打过补丁的衣是什么意思
- 打过门是什么意思
- 打过门纸是什么意思
- 打近乎是什么意思
- 打近人是什么意思
- 打进一步是什么意思
- 打进子是什么意思
- 打进步是什么意思