等压平衡式
等压平衡式dengya pinghengshi
温度的变化主要是改变平衡常数的值,它对溶液浓度的影响完全可以忽略。由热力学原理知,平衡常数与反应标准自由焓变间的关系
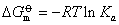
该式表示在一定温度下,平衡常数数值的大小完全由
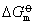 决定。而
决定。而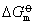 仅是温度的函数,与物质的量无关。因此,温度一定,Ka是个定值。说明平衡常数只与温度有关而与浓度或压力无关。经热力学的严格论证,平衡常数随温度的变化有如下关系
仅是温度的函数,与物质的量无关。因此,温度一定,Ka是个定值。说明平衡常数只与温度有关而与浓度或压力无关。经热力学的严格论证,平衡常数随温度的变化有如下关系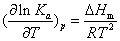
式中 Ka——平衡常数
△Hm——反应摩尔等压反应热T——温度R——气体常数
该式是J. H.范霍夫于1885年导出的,称范霍夫等压平衡式。
由上式可知,lnKa随温度的变化率决定于△Hm

平衡常数随温度升高而减小,说明升温对正向反应不利。若反应既不放热又不吸热,即△Hm=0,

☚ 平衡常数的单位 浓度(分压)对化学平衡的影响 ☛
- 卷毛耳草是什么意思
- 卷毛耳草是什么意思
- 卷烟是什么意思
- 卷烟是什么意思
- 卷烟专卖是什么意思
- 卷烟余味是什么意思
- 卷烟保管是什么意思
- 卷烟分级计税标准是什么意思
- 卷烟分级计税标准是什么意思
- 卷烟刺激性是什么意思
- 卷烟劲头是什么意思
- 卷烟包装是什么意思
- 卷烟受潮是什么意思
- 卷烟吃味是什么意思
- 卷烟商情是什么意思
- 卷烟商情机构是什么意思
- 卷烟地区差价是什么意思
- 卷烟坚实度与瘪陷性是什么意思
- 卷烟工艺与设备是什么意思
- 卷烟广告规定是什么意思
- 卷烟批发价格是什么意思
- 卷烟批零差价是什么意思
- 卷烟有效保存期是什么意思
- 卷烟杂气是什么意思
- 卷烟烟碱是什么意思
- 卷烟焦油是什么意思
- 卷烟燃烧性与灰色是什么意思
- 卷烟类品率是什么意思
- 卷烟纸、滤嘴棒、烟用丝束、烟草专用机械的生产和销售是什么意思
- 卷烟纸、滤嘴棒、烟用丝束、烟草专用机械的生产和销售是什么意思
- 卷烟纸填料灰分的快速测定计算是什么意思
- 卷烟纸燃烧度的计算是什么意思
- 卷烟统税是什么意思
- 卷烟色泽是什么意思
- 卷烟评吸是什么意思
- 卷烟调拨价格是什么意思
- 卷烟质量评定是什么意思
- 卷烟配方是什么意思
- 卷烟集市价格是什么意思
- 卷烟零售价格是什么意思
- 卷烟霉变是什么意思
- 卷烟香气是什么意思
- 卷甲而趋,日夜不处,倍道兼行,百里而争利,则擒三将军,劲者先,疲者后,其法十一而至;五十里而争利,则蹶上将军,其法半至;三十里而争利,则三分之二至是什么意思
- 卷疮散是什么意思
- 卷皱纸是什么意思
- 卷积云(云)(cirrocumulus,简写Cc)是什么意思
- 卷积码是什么意思
- 卷端(卷端书题)是什么意思
- 卷筒是什么意思
- 卷筒是什么意思
- 卷筒中纸的长度的计算是什么意思
- 卷筒包装机是什么意思
- 卷筒的角速度计算是什么意思
- 卷筒纸产量的计算是什么意思
- 卷筒纸在机重量估算是什么意思
- 卷筒纸的包装是什么意思
- 卷筒纸胶印机是什么意思
- 卷筒组是什么意思
- 卷纬机是什么意思
- 卷纲机是什么意思