配合物的形成
配合物的形成peihewu de xingcheng
配合物的形成与一般化学反应不同,既无电子的转移,又没有成键原子双方提供电子形成共用电子对。多数情况为,一方提供空轨道 (中心离子或中心原子),另一方提供孤对电子 (配位体),形成了配位键。例如:
CuSO4+4NH3=[Cu(NH3)4]SO4
FeCl3+KSCN=[Fe(SCN)]Cl2+KCl
CuSO4+5H2O=[Cu(H2O)4]SO4·H2O
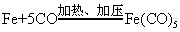
此外,在形成π配合物时,配位体中无孤对电子,而是提供π电子形成配位键,同时形成反馈π键。
参见“配位化合物”,“金属羰基配合物”。
☚ 在空气中易变质的一些物质 配合物在溶液中的反应 ☛
- 作战的阵法是什么意思
- 作战目标是什么意思
- 作战目的是什么意思
- 作战空域是什么意思
- 作战管理是什么意思
- 作战管理学是什么意思
- 作战类型是什么意思
- 作战系统是什么意思
- 作战系统工程学是什么意思
- 作战纲要是什么意思
- 作战线是什么意思
- 作战经过图是什么意思
- 作战经验丰富是什么意思
- 作战结局是什么意思
- 作战结束时间是什么意思
- 作战结束阶段后勤指挥是什么意思
- 作战统计学是什么意思
- 作战编成是什么意思
- 作战而死是什么意思
- 作战能力是什么意思
- 作战能力对比是什么意思
- 作战能力计算是什么意思
- 作战舰队是什么意思
- 作战英勇是什么意思
- 作战英勇,无可阻挡是什么意思
- 作战行动是什么意思
- 作战行动凭借的地点是什么意思
- 作战装备审计是什么意思
- 作战要先抓主要敌手是什么意思
- 作战要求是什么意思
- 作战要点是什么意思
- 作战规律是什么意思
- 作战规模是什么意思
- 作战计划是什么意思
- 作战计划图是什么意思
- 作战计划拟制是什么意思
- 作战计算是什么意思
- 作战训练是什么意思
- 作战训练参谋是什么意思
- 作战训练科是什么意思
- 作战识记能力是什么意思
- 作战调度能力是什么意思
- 作战负伤流血是什么意思
- 作战费是什么意思
- 作战费责任支付是什么意思
- 作战运用原则是什么意思
- 作战运筹是什么意思
- 作战运筹学是什么意思
- 作战运输是什么意思
- 作战部是什么意思
- 作战部署是什么意思
- 作战部署图是什么意思
- 作战部门是什么意思
- 作战部队是什么意思
- 作战部队向近距离的目标敌人做迅猛进攻的战斗行动是什么意思
- 作战部队组建扩编开办费是什么意思
- 作战重点是什么意思
- 作战队伍的组合方式、排列形式是什么意思
- 作战阶段是什么意思
- 作战预案是什么意思