酸与碱的中和反应
酸与碱的中和反应suan yu jian de zhonghe fanying
复分解反应的类型之一,产物中有弱电解质——水。这类反应的总规律是强酸与强碱易反应,强酸与弱碱、强碱与弱酸可反应,弱酸与弱碱不易反应。
强酸、强碱在水中全部电离,氢离子和氢氧根离子能迅速结合成水分子,反应极易发生。例如:
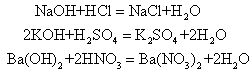
H++OH-=H2O
弱酸 (或弱碱) 在水中部分电离,加入强碱 (或强酸) 后,氢氧根离子 (或氢离子) 可与弱酸 (或弱碱) 电离出的少量氢离子 (或氢氧根离子) 结合,生成水分子,促进了弱酸 (或弱碱) 的进一步电离,如果弱酸 (或弱碱) 难溶,还能进一步溶解,使反应发生。例如:
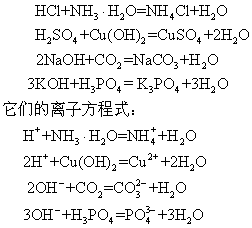
弱酸、弱碱在水中电离出的氢离子或氢氧根离子较少,基本上不发生反应。例如,氢氧化铝和氢硫酸、氢氧化铜和碳酸、氢氧化铁和硅酸等都不能反应。当弱酸或弱碱稍强时,也可发生反应,例如,氨水或醋酸能与许多弱酸或弱碱反应:
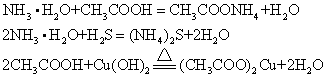
此外,多元酸与碱反应时,酸、碱的摩尔比不同时,可生成正盐或酸式盐,例如:
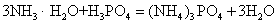
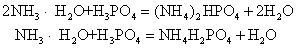
☚ 复分解反应发生的条件 酸与盐之间的复分解反应 ☛
- 客户服务/技术支持是什么意思
- 客户服务部是什么意思
- 客户机是什么意思
- 客户汇率是什么意思
- 客户流量是什么意思
- 客户经理是什么意思
- 客户群体研究方法是什么意思
- 客户落订技巧是什么意思
- 客户调查是什么意思
- 客户调查的内容是什么意思
- 客户资信调查咨询业务是什么意思
- 客户身份资料和交易记录保存制度是什么意思
- 客户迁入程序是什么意思
- 客户预付款是什么意思
- 客户风险是什么意思
- 客房是什么意思
- 客房使用率是什么意思
- 客房内小型酒吧是什么意思
- 客房女服务员是什么意思
- 客房服务是什么意思
- 客房服务员是什么意思
- 客房浴室是什么意思
- 客房用品是什么意思
- 客房电话是什么意思
- 客房男服务员是什么意思
- 客房部经理是什么意思
- 客搭客搭是什么意思
- 客散他乡夜,人归故国秋。是什么意思
- 客散同秋叶,人亡似夜川。是什么意思
- 客散茶甘留舌本,睡馀书味在胸中。是什么意思
- 客散青天月,山空碧水流。是什么意思
- 客散高楼上,帆飞细雨中。是什么意思
- 客方言是什么意思
- 客旅是什么意思
- 客旅的情怀是什么意思
- 客旅纳课买茶三日内不赴官司批纳引目是什么意思
- 客旌是什么意思
- 客星是什么意思
- 客星侵帝座是什么意思
- 客星山人是什么意思
- 客星散人是什么意思
- 客星敬人是什么意思
- 客星犯帝是什么意思
- 客星犯帝座(打《尚书》一句)以近天子之光是什么意思
- 客星犯斗是什么意思
- 客星龛是什么意思
- 客曹是什么意思
- 客曹尚书是什么意思
- 客曹郎是什么意思
- 客有不速是什么意思
- 客有为余话登天坛遇雨之状因以赋之 - 刘禹锡 - 清晨登天坛,半路逢阴晦。疾行穿雨过,却立视云背。白日照其上,风雷走于内。滉漾雪海翻,槎牙玉山碎。蛟龙露是什么意思
- 客有在中坐,颂歌复何如。是什么意思
- 客有神仙者,于兹雅丽陈。是什么意思
- 客服是什么意思
- 客木匠—— 一锯是什么意思
- 客木匠——一锯是什么意思
- 客机是什么意思
- 客来不速是什么意思
- 客来东道远,归去北风高。是什么意思
- 客来主人欢,客走主人宽是什么意思