1.等温等容条件下:
(1)对于反应物为一种的反应,
❶ 对于气体系数减小的反应,如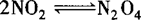 ,在原平衡的基础上,再加入NO2,会使平衡向右移动,但由于NO2增多,引起压强增大,导致平衡向右移动的趋势增大,转化率增大;
,在原平衡的基础上,再加入NO2,会使平衡向右移动,但由于NO2增多,引起压强增大,导致平衡向右移动的趋势增大,转化率增大;
❷ 对于气体系数不变的反应,如2HBr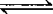 Br2+H2,在原平衡的基础上,再加入HBr,会使平衡向右移动,由于HBr的增多,引起压强增大,压强的改变对该平衡没有影响,转化率不变;
Br2+H2,在原平衡的基础上,再加入HBr,会使平衡向右移动,由于HBr的增多,引起压强增大,压强的改变对该平衡没有影响,转化率不变;
❸ 对于气体系数增大的反应,如PCl5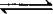 PCl3+Cl2,在原平衡的基础上,再加入PCl5气体,会使平衡向右移动,由于PCl5气体的增多,引起压强增大,抑制平衡向右移动,转化率减小.
PCl3+Cl2,在原平衡的基础上,再加入PCl5气体,会使平衡向右移动,由于PCl5气体的增多,引起压强增大,抑制平衡向右移动,转化率减小.
(2)对于反应物为两种或两种以上的气体可逆反应,如aA+bB=cC+dD,
❶ 如果只增加一种反应气体,则使另一种反应物的转化率增大,而其本身的转化率减小;
❷ 如果所有气体反应物都同等倍数增加,其转化率的变化情况与前后系数有关,其变化情况如下所述.例如:
对反应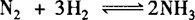 ,分别以1molN2和1molH2为起始量与以2molN2、2molH2为起始量,其转化率增大.
,分别以1molN2和1molH2为起始量与以2molN2、2molH2为起始量,其转化率增大.
对反应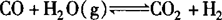 ,分别以1molCO和1molH2O(g)为起始量与以2molCO和2molH2O为起始量,其转化率不变.
,分别以1molCO和1molH2O(g)为起始量与以2molCO和2molH2O为起始量,其转化率不变.
同样,对反应系数增大的气体反应,分别以上述两种起始量反应,其转化率减小.
2.等温等压条件下,对于气体反应,对于同等倍数增加反应物量时,上述情况下平衡不移动,所以转化率不发生改变.
例 在一定温度下,一定体积的密闭容器中有如下平衡: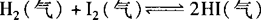
已知H2和I2的起始浓度均为0.10mol·L—1时,达平衡时HI的浓度为016mol·L—1.若H2和I2的起始浓度均变为0.20mol·L—1,则平衡时H2的浓度(mol·L—1)是( ).
A.0.16 B,0,08
C.0.04 D.0.02
解析 在恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,则两平衡等效.根据题给条件,若H2和I2的起始浓度均变为0.20mol·L—1,则平衡时HI的浓度为0.32mol·L—1,H2的浓度为0.20mol·L—1—0.16mol·L—1=0.04mol·L—1.
答 C.
- 知识经济社会经济体制构建是什么意思
- 知识结构是什么意思
- 知识结构主义是什么意思
- 知识编码化是什么意思
- 知识缺乏,很不懂事是什么意思
- 知识网络是什么意思
- 知识老化是什么意思
- 知识考古学是什么意思
- 知识节是什么意思
- 知识表征是什么意思
- 知识观念是什么意思
- 知识论是什么意思
- 知识论的无政府主义是什么意思
- 知识词典是什么意思
- 知识财产是什么意思
- 知识=财富是什么意思
- 知识贫乏是什么意思
- 知识贬值是什么意思
- 知识资本是什么意思
- 知识资本化是什么意思
- 知识转让是什么意思
- 知识还原社会是什么意思
- 知识进化是什么意思
- 知识进化利润是什么意思
- 知识银行是什么意思
- 知识阶是什么意思
- 知识阶层是什么意思
- 知识阶级与政治是什么意思
- 知识青年是什么意思
- 知识青年上山下乡是什么意思
- 知识青年上山下乡运动是什么意思
- 知识青年办公室是什么意思
- 知识青年招工后工资是什么意思
- 知识青年支援边疆是什么意思
- 知识革命和知识大爆炸是什么意思
- 知识领域是什么意思
- 知识﹑气度﹑性格等方面宽阔博大是什么意思
- 知识,经验是什么意思
- 知译经院是什么意思
- 知询于愚,或有得也。是什么意思
- 知诱是什么意思
- 知谁墙外千竿竹,分我窗西一亩阴。是什么意思
- 知谁福。是什么意思
- 知谁语。是什么意思
- 知谋是什么意思
- 知谋将帅科是什么意思
- 知谏院是什么意思
- 知谢是什么意思
- 知贡举是什么意思
- 知贡举官是什么意思
- 知贤之谓明,辅贤之谓能。是什么意思
- 知贤之近途,莫急于考功。是什么意思
- 知贤之途莫近于考功,是什么意思
- 知贤非难,用贤为难是什么意思
- 知费之为省,善省者也,而以省为省者愚,其费必倍。知劳之为逸者,善逸者也,而以逸为逸者昏,其劳必多。知苦之为乐者,善乐者也,而以乐为乐者痴,一苦不返。知通之为塞者,善塞者也,而以塞为塞者拙,一通必竭。是什么意思
- 知赋是什么意思
- 知赏是什么意思
- 知起居事是什么意思
- 知起居注是什么意思
- 知趣是什么意思