1.铁的原子结构:
原子序数为26,位于元素周期表中第四周期Ⅷ族,原子最外层只有2个电子,在化学反应中容易失去这两个电子变成Fe2+,也能失去3个电子变成Fe3+,从而显+2价或+3价
注 ❶ 在铁的+2价和+3价化合物中,+3价的化合物较稳定
❷ +3价并不是铁的最高化合价.
2.铁的化学性质:
(1)铁与非金属反应
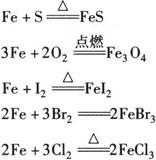
注 在常温下,干燥液态氯(Cl2)与铁不发生反应,故液氯常用钢瓶盛装.
(2)铁与水反应:在高温下Fe与水蒸气反应
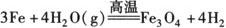
注 在常温下,Fe与H2O不反应,但在水和空气里的O2、CO2等共同作用下,Fe却很容易被腐蚀.
(3)铁与酸反应:
a.铁与盐酸、稀硫酸等非强氧化性酸反应时,铁被氧化为+2价的铁,酸中的H+被还原为H2.
b.在常温下,铁遇到浓硫酸、浓硝酸时,则发生钝化(生成致密的氧化物薄膜,这层薄膜可阻止内部金属进一步被氧化).
c.在常温下,铁被稀硝酸氧化,反应产物有硝酸铁和水,其他产物一般为一氧化氮.在加热的条件下,铁被浓硝酸、浓硫酸氧化,铁被氧化为+3价铁盐,酸的还原产物一般为二氧化氮(HNO3反应),二氧化硫(H2SO4反应).过量的铁能将+3价铁还原为+2价铁.
(4)铁与比其活动性弱的金属的盐溶液发生置换反应:
Fe+CuCl2=FeCl2+Cu
Fe+2Ag+=Fe2++2Ag
注 a.铁与S、I2、非氧化性酸(H+)、盐溶液等弱氧化剂反应时,生成Fe2+化合物.
b.铁与Cl2、Br2、硝酸等强氧化剂反应时,生成Fe3+化合物.
c.铁与O2和H2O(g)反应时生成Fe3O4.
- 祖台之是什么意思
- 祖台之志怪是什么意思
- 祖司麻是什么意思
- 祖司麻甲素是什么意思
- 祖君是什么意思
- 祖君彦是什么意思
- 祖吴是什么意思
- 祖咏是什么意思
- 祖咏·望蓟门是什么意思
- 祖咏·终南望余雪是什么意思
- 祖咏·终南望馀雪是什么意思
- 祖咏《望蓟门》是什么意思
- 祖咏《望蓟门》全诗原文、注释、翻译和赏析是什么意思
- 祖咏《望蓟门》 - 唐山水诗赏析是什么意思
- 祖咏《望蓟门》,少小虽非投笔吏,论功还欲请长缨。是什么意思
- 祖咏《终南望余雪》是什么意思
- 祖咏《终南望余雪》全诗原文、注释、翻译和赏析是什么意思
- 祖咏《终南望余雪》 - 唐山水诗赏析是什么意思
- 祖咏《终南望余雪》,唐诗之中的一首咏雪写雪的诗词名篇是什么意思
- 祖咏《终南望余雪》,终南阴岭秀,积雪浮云端。 林表明霁色,城中增暮寒。是什么意思
- 祖咏意尽辍笔是什么意思
- 祖咏的诗词鉴赏是什么意思
- 祖咏的诗,祖咏的诗集,祖咏的古诗词大全是什么意思
- 祖咏集是什么意思
- 祖哈克与魔鬼是什么意思
- 祖国是什么意思
- 祖国·我回来了是什么意思
- 祖国万岁是什么意思
- 祖国不会忘记是什么意思
- 祖国之歌是什么意思
- 祖国之歌 [德国]克洛卜施托克是什么意思
- 祖国之泪 [德国]格吕菲乌斯是什么意思
- 祖国之父是什么意思
- 祖国光复会是什么意思
- 祖国医学之最是什么意思
- 祖国医学的心理治疗是什么意思
- 祖国各地是什么意思
- 祖国呵,我亲爱的祖国)(舒婷)是什么意思
- 祖国啊,我亲爱的祖国是什么意思
- 祖国啊,我要燃烧是什么意思
- 祖国啊,母亲!是什么意思
- 祖国在呼唤是什么意思
- 祖国在我心中活动是什么意思
- 祖国宝岛千般秀(打朝鲜地名一)万景台是什么意思
- 祖国山河非常美丽是什么意思
- 祖国(或以梦为马)是什么意思
- 祖国最北边的黑龙江省是什么意思
- 祖国的吼声是什么意思
- 祖国的血是什么意思
- 祖国的黎明是什么意思
- 祖国纪事是什么意思
- 祖国纪行是什么意思
- 祖国统一是什么意思
- 祖国统一后台湾可以实行同大陆不同的制度是什么意思
- 祖国统一大业是什么意思
- 祖国统一寄希望于台湾当局台湾人民是什么意思
- 祖国统一工作组是什么意思
- 祖国进行曲是什么意思
- 祖国阵线报(保加利亚)是什么意思
- 祖国陆沉人有责,天涯飘泊我无家是什么意思