求中和热
求中和热qiu zhonghere
酸碱中和反应是放热反应,在稀溶液中(1mol·L-1以下),1摩尔H+和1摩尔OH-发生中和反应而生成1摩尔水的反应热,就是中和热。中和热是一个定值——57.3kJ·mol-1。
H++OH-=H2O △Hm=57.3kJ·mol-1
有二元强酸参加的中和反应,酸的二步电离需吸收热量; 弱酸跟弱碱中和,分子电离成离子要吸收热量,放出的热量要少,测出的中和热数值偏低。
例1 含有10g Ba(OH)2的溶液跟适量硫酸反应,放热Q=6.646kJ,求该反应的中和热。
解 10g Ba(OH)2中含OH-的物质的量n(OH-)=10/171×2 mol,生成1mol H2O时放热:
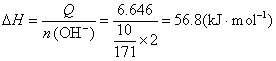
答 该反应的中和热为56.8 kJ·mol-1。
通过测定反应前后溶液温度的变化,可利用下式确定中和反应放出的热量:
Q=c·m·△t
式中 c——比热容 (J·g-1·K-1或kJ·kg-1·K-1)
m——溶液的质量(g或kg)
△t——溶液的温度升高量(K或℃)
水及稀溶液密度ρ=1g·mL-3;比热c=4.18 J·g-1·K-。
例2 根据表中数据,求中和热。
| 实验 次数 | HCl溶液 | NaOH溶液 | 溶液温度 | |||
| 浓度/ mol ·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 混合前/ t1 | 混合后/ t2 | |
| Ⅰ | 2 | 100 | 2 | 100 | 20 | 33.6 |
| Ⅱ | 1 | 150 | 1 | 150 | 20 | 26.8 |
解
❶根据实验Ⅰ数据:
Q=c·m·△t=4.18×(100+100)×(33.6-20)≈11.37(kJ)
依题意: (2×0.1)mol的HCl和NaOH中和生成(2×0.1)mol水时放出11.37kJ的热量,反应的中和热是

❷根据实验Ⅱ数据得:
Q=4.18×(150+150)×(26.8-20)=8527(J)
生成(1×0.15)mol水时放出热量8.527 kJ,中和热是
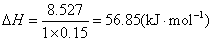
答 实验Ⅰ和Ⅱ的中和热都是56.85kJ·mol-1。根据实验知道,用相同浓度、相同体积的酸跟碱中和时,测得的温度和热量有如下规律:
❶溶液温度升高度数与所用酸与碱的体积多少无关;
❷所用酸与碱浓度愈大,反应放出热量愈多。例 3 0.11mol· L-1 NaOH溶液100mL和0.1mol·L-1盐酸100 mL混合后能放出多少热量?混合后溶液温度升高多少?
解 由题意知氢氧化钠过量,以HCl计算。设该反应放出热量为Q:


答 能放出573J热量,溶液温度升高1.46℃。
☚ 求反应热 键能的计算 ☛
- 宋拓唐李邕书李思训碑是什么意思
- 宋拓多宝佛塔感应碑是什么意思
- 宋拓大达法师玄秘塔是什么意思
- 宋拓天发神谶碑是什么意思
- 宋拓太清楼书谱是什么意思
- 宋拓薛绍彭摹刻兰亭序是什么意思
- 宋拓道因法师碑是什么意思
- 宋拓麓山寺碑并阴是什么意思
- 宋拾遗是什么意思
- 宋振是什么意思
- 宋振明是什么意思
- 宋振榘是什么意思
- 宋振绪是什么意思
- 宋振铭是什么意思
- 宋振骐是什么意思
- 宋搨《岳麓寺碑》跋是什么意思
- 宋搨法华寺碑跋是什么意思
- 宋攻交趾富良江之战是什么意思
- 宋攻契丹岐沟关之战是什么意思
- 宋攻杨么义军阳武口之战是什么意思
- 宋政和礼器考是什么意思
- 宋敏求是什么意思
- 宋敏求是什么意思
- 宋敏求是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁是什么意思
- 宋教仁墓是什么意思
- 宋教仁案是什么意思
- 宋教仁遇刺案是什么意思
- 宋教仁集是什么意思
- 宋文是什么意思
- 宋文是什么意思
- 宋文信是什么意思
- 宋文公是什么意思
- 宋文周是什么意思
- (宋)文天祥 北归宿中川寺是什么意思
- 宋文宪公壁峯禅师塔铭是什么意思
- 宋文宪集是什么意思
- 宋文帝是什么意思
- 宋文帝(407—453)是什么意思
- 宋文帝(刘义隆)是什么意思
- 宋文政是什么意思
- 宋文治是什么意思
- 宋文治是什么意思
- 宋文治画集是什么意思
- 宋文琪是什么意思
- 宋文翰是什么意思
- 宋文薰是什么意思
- 宋文选是什么意思
- 宋文郁是什么意思
- 宋文鉴是什么意思