盖斯定律
盖斯定律gaisi dinglu
1840年G·H·盖斯分析了大量的热化学实验数据,提出了盖斯定律。其内容是“不论化学反应是一步实现,还是分几步完成,其反应热总是相同。”就是说,反应热只与反应的始态、终态有关,而与所经历的途径无关(见右图)。
由图可得 Q=Q′1+Q″1=Q′2+Q″2+Q2
热(Q)本来是个过程的量,与途径有关。但若过程满足不做非体积功的等压或等容限制条件时,反应热的值只由始、终态决定而与途径无关。因为不做非体积功的等容过程,则 Qv=△U;等压过程,则QP=△H。显然,盖斯定律是能量转化与守恒原理的必然结果,实际也是能量守恒原理在化学过程的具体应用。有了盖斯定律就可以使热化学方程式象普通的代数式那样进行加减运算,用已精确测量的反应热,计算难于测量或暂时未能测量的反应热。因此,盖斯定律是利用热化学方程式计算反应热的理论基础。但应用盖斯定律求算某个反应的热效应,固然可引入一些别的反应,设想一些中间步骤 (无论实际反应能否真正按此步骤进行),而因反应热的测定难免有误差,还是以少引入别的反应为宜。
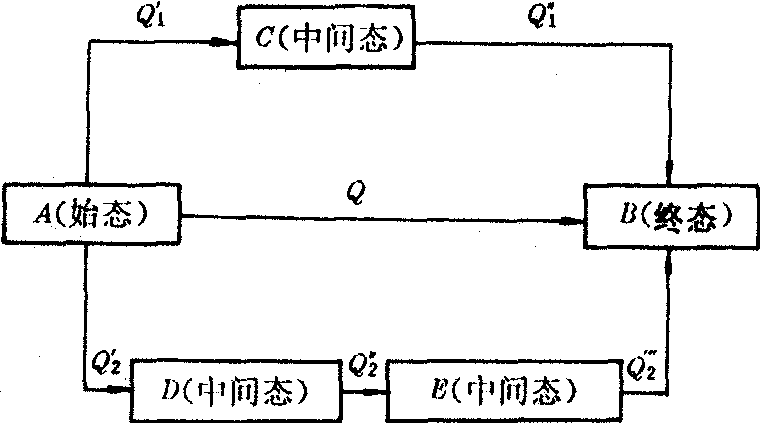
盖斯定律示意图
☚ 中和热 反应热的估算 ☛
盖斯定律
热化学定律。若是一个反应可以分为几步进行,则分步反应的反应热之总和与这个反应一次发生时的反应热相同。俄国化学家盖斯(Γ.И.Γecc,1802—1850)于1836年提出。
- 散文是什么意思
- 散文是什么意思
- 散文是什么意思
- 散文是什么意思
- 散文是什么意思
- 散文是什么意思
- 散文丛书是什么意思
- 散文写作教程是什么意思
- 散文十二家是什么意思
- 散文十六美是什么意思
- 散文天地是什么意思
- 散文式结构是什么意思
- 散文式结构是什么意思
- 散文技巧是什么意思
- 散文特写选(1949—1979)是什么意思
- 散文电影是什么意思
- 散文的分类是什么意思
- 散文的声音节奏是什么意思
- 散文的春天是什么意思
- 散文精神是什么意思
- 散文诗是什么意思
- 散文诗是什么意思
- 散文诗是什么意思
- 散文诗是什么意思
- 散文诗的世界是什么意思
- 散文诗的精灵是什么意思
- 散文阅读法是什么意思
- 散斑竹根七是什么意思
- 散斑竹根七是什么意思
- 散曲是什么意思
- 散曲是什么意思
- 散曲是什么意思
- 散曲是什么意思
- 散曲是什么意思
- 散曲是什么意思
- 散曲丛刊是什么意思
- 散曲丛刊是什么意思
- 散曲通论是什么意思
- 散曲通论是什么意思
- 散木是什么意思
- 散木是什么意思
- 散木印艺是什么意思
- 散木(散材)是什么意思
- 散板了是什么意思
- 散歌是什么意思
- 散步是什么意思
- 散步是什么意思
- 散步 漫步 溜达(蹓跶)是什么意思
- 散步健身法是什么意思
- 散毒万灵丸是什么意思
- 散氏盘是什么意思
- 散氏盘是什么意思
- 散氏盘是什么意思
- 散氏盘是什么意思
- 散氏盘是什么意思
- 散氏盘是什么意思
- 散氏盘铭是什么意思
- 散水法是什么意思
- 散湿是什么意思
- 散滞汤是什么意思